Bài tập về phản ứng oxi hóa khử và cách giải
Với bài viết Bài tập về phản ứng oxi hóa khử và cách giải sẽ giúp học sinh nắm vững lý thuyết, biết cách làm bài tập từ đó có kế hoạch ôn tập hiệu quả để đạt kết quả cao trong các bài thi môn Hóa học 8.
A. Lý thuyết và phương pháp giải
- Một số khái niệm cần nắm vững:
+ Sự tách oxi khỏi hợp chất là sự khử.
+ Sự tác dụng của oxi với một chất là sự oxi hóa.
+ Chất khử là chất chiếm oxi của chất khác.
+ Chất oxi hóa là chất nhường oxi cho chất khác.
+ Phản ứng oxi hóa khử là phản ứng hóa học trong đó xảy ra đồng thời sự oxi hóa và sự khử.
Ví dụ:
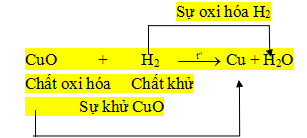
- Phương pháp giải.
+ Bước 1: Tính số mol các chất đã cho.
+ Bước 2: Viết phương trình hóa học.
+ Bước 3: Xác định chất dư, chất hết.
+ Bước 4: Tính toán theo yêu cầu đề bài.
+ Ngoài ra có thể áp dụng định luật bảo toàn khối lượng, bảo toàn nguyên tố để giải toán.
B. Ví dụ minh họa.
Ví dụ 1: Phát biểu nào sau đây đúng?
A. Chất chiếm oxi của chất khác là chất oxi hóa.
B. Chất nhường oxi cho chất khác là chất khử.
C. Sự tách oxi ra khỏi hợp chất là sự khử.
D. Sự tách oxi ta khỏi hợp chất là sự oxi hóa.
Hướng dẫn giải:
- Chất chiếm oxi của chất khác là chất khử.
- Chất nhường oxi cho chất khác là chất oxi hóa.
- Sự tách oxi ra khỏi hợp chất là sự khử.
Đáp án C
Ví dụ 2: Hãy cho biết trong những phản ứng hóa học sau đây, phản ứng nào là phản ứng oxi hóa – khử? Lợi ích và tác dụng của mỗi phản ứng?
- Đốt than trong lò: (1)
- Nung vôi: (2)
- Sắt để ngoài không khí bị gỉ: (3)
Hướng dẫn giải:
- Phản ứng (1), (3) là phản ứng oxi hóa khử.
- Phản ứng (1): Phản ứng đốt cháy than trong lò tỏa nhiệt lượng cần thiết.
- Phản ứng (2): Phản ứng nung đá vôi tạo ra vôi sống CaO đây là phản ứng phân hủy giúp ta có vôi sống để dùng trong công nghiệp hay xây dựng công trình và dân dụng.
- Phản ứng (3): Đây là phản ứng có hại, làm gỉ sắt kim loại.
Ví dụ 3: Khử 32 gam copper (II) oxide bằng khí hiđro thì khối lượng kim loại đồng thu được là
A. 38,4 gam.
B. 44 gam.
C. 48 gam.
D. 25,6 gam.
Hướng dẫn giải:
nCuO = 32 : (64 + 16) = 0,4 mol.
Phương trình phản ứng:
Vậy khối lượng kim loại đồng là 0,4.64 = 25,6 gam.
Đáp án D
C. Tự luyện.
Câu 1: Cho phản ứng sau: . Chất khử là
A. Na.
B. O2.
C. Na2O.
D. không có đáp án.
Hướng dẫn giải:
Chất khử là chất lấy oxi của chất khác. Trong phản ứng này Na lấy oxi nên Na là chất khử.
Đáp án A
Câu 2: Phản ứng nào dưới đây là phản ứng oxi hóa – khử?
A.
B.
C.
D.
Hướng dẫn giải:
Phản ứng oxi hóa – khử là:
Trong đó Fe là chất khử và Oxi là chất oxi hóa.
Đáp án D
Câu 3: Trong phản ứng oxi hóa – khử, kim loại luôn đóng vai trò là chất gì?
A. Chất oxi hóa.
B. Chất khử.
C. Chất xúc tác.
D. Chất môi trường.
Hướng dẫn giải:
Trong phản ứng oxi hóa – khử, kim loại luôn đóng vai trò là chất khử.
Đáp án B
Câu 4: Khử hoàn toàn 16 gam một oxit của kim loại X (có hóa trị II) cần vừa đủ 4,48 lít H2 (đktc). Xác định kim loại X?
A. Fe.
B. Mg.
C. Hg.
D. Cu.
Hướng dẫn giải:
Gọi công thức của oxit là XO (do X có hóa trị II)
n hiđro = 4,48 : 22,4 = 0,2 mol
Phương trình phản ứng:
Khối lượng của oxit là 0,2.(MX + 16) = 16 gam
Suy ra MX + 16 = 80 và MX = 64 (g/mol)
Vậy X là Cu
Đáp án D
Câu 5: Trong những oxit sau: CuO, MgO, Al2O3, Ag2O, FeO, Na2O. Có bao nhiêu oxit bị khử bởi hiđro ở nhiệt độ cao?
A. 2.
B. 3.
C. 4.
D. 5.
Hướng dẫn giải:
Những oxit bị khử bởi hiđro ở nhiệt độ cao là: CuO, Ag2O, FeO.
Đáp án B
Câu 6: Khử 12 gam copper (II) oxide bằng khí hiđro thu được 6,4 gam đồng. Hiệu suất của phản ứng là
A. 50%.
B. 60%.
C. 66,67%.
D. 85%.
Hướng dẫn giải:
Phương trình phản ứng:
Suy ra hiệu suất của phản ứng là
Đáp án C
Câu 7: Phản ứng nào không phải là phản ứng oxi hóa - khử?
A.
B.
C.
D.
Hướng dẫn giải:
Phản ứng không phải phản ứng oxi hóa - khử là
Đáp án C
Câu 8: Oxit nào bị khử bởi hiđro?
A. Na2O.
B. CaO.
C. BaO.
D. PbO.
Hướng dẫn giải:
PbO là oxit bị khử bởi hiđro
Đáp án D
Câu 9: Cho các phản ứng sau, phản ứng nào là phản ứng oxi hóa khử?
A.
B.
C.
D.
Hướng dẫn giải:
Phản ứng oxi hóa khử là , vừa xảy ra sự oxi hóa và sự khử.
Đáp án A
Câu 10: Đốt cháy 3,1 gam photpho trong bình chứa oxi dư tạo ra diphosphorus pentoxide. Tính khối lượng oxit thu được sau phản ứng?
A. 1,42 gam.
B. 1,45 gam.
C. 7,1 gam.
D. 14,2 gam.
Hướng dẫn giải:
nP = 3,1 : 31 = 0,1 mol
Phương trình hóa học:
0,1 0,05 mol
Vậy khối lượng oxit là 0,05.142 = 7,1 gam
Đáp án C
Xem thêm phương pháp giải các dạng bài tập Hóa học lớp 8 hay, chi tiết khác:
- Điều chế H2, phản ứng thế và cách giải bài tập
- Kim loại tác dụng với nước và cách giải bài tập
- Oxit tác dụng với nước và cách giải bài tập
- Nhận biết, phân biệt chất hóa học và cách giải bài tập
- Xác định công thức hóa học và gọi tên axit, bazơ và muối và cách giải bài tập
- Giải Tiếng Anh 8 Global Success
- Giải sgk Tiếng Anh 8 Smart World
- Giải sgk Tiếng Anh 8 Friends plus
- Lớp 8 - Kết nối tri thức
- Soạn văn 8 (hay nhất) - KNTT
- Soạn văn 8 (ngắn nhất) KNTT
- Giải sgk Toán 8 - KNTT
- Giải sgk Khoa học tự nhiên 8 - KNTT
- Giải sgk Lịch Sử 8 - KNTT
- Giải sgk Địa Lí 8 - KNTT
- Giải sgk Giáo dục công dân 8 - KNTT
- Giải sgk Tin học 8 - KNTT
- Giải sgk Công nghệ 8 - KNTT
- Giải sgk Hoạt động trải nghiệm 8 - KNTT
- Giải sgk Âm nhạc 8 - KNTT
- Lớp 8 - Chân trời sáng tạo
- Soạn văn 8 (hay nhất) - CTST
- Soạn văn 8 (ngắn nhất) - CTST
- Giải sgk Toán 8 - CTST
- Giải sgk Khoa học tự nhiên 8 - CTST
- Giải sgk Lịch Sử 8 - CTST
- Giải sgk Địa Lí 8 - CTST
- Giải sgk Giáo dục công dân 8 - CTST
- Giải sgk Tin học 8 - CTST
- Giải sgk Công nghệ 8 - CTST
- Giải sgk Hoạt động trải nghiệm 8 - CTST
- Giải sgk Âm nhạc 8 - CTST
- Lớp 8 - Cánh diều
- Soạn văn 8 Cánh diều (hay nhất)
- Soạn văn 8 Cánh diều (ngắn nhất)
- Giải sgk Toán 8 - Cánh diều
- Giải sgk Khoa học tự nhiên 8 - Cánh diều
- Giải sgk Lịch Sử 8 - Cánh diều
- Giải sgk Địa Lí 8 - Cánh diều
- Giải sgk Giáo dục công dân 8 - Cánh diều
- Giải sgk Tin học 8 - Cánh diều
- Giải sgk Công nghệ 8 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 8 - Cánh diều
- Giải sgk Âm nhạc 8 - Cánh diều
